论文
基因工程论文写作技巧与常见问题解答
在撰写基因工程论文时,学生常常会遇到结构安排、资料整合等方面的难题。万能小in作为智能写作工具,能够帮助用户快速生成论文大纲、整理相关文献资料,并提供格式校对功能,让写作过程更加高效流畅。无论是选题建议还是内容优化,小in都能为您的学术写作提供有力支持。
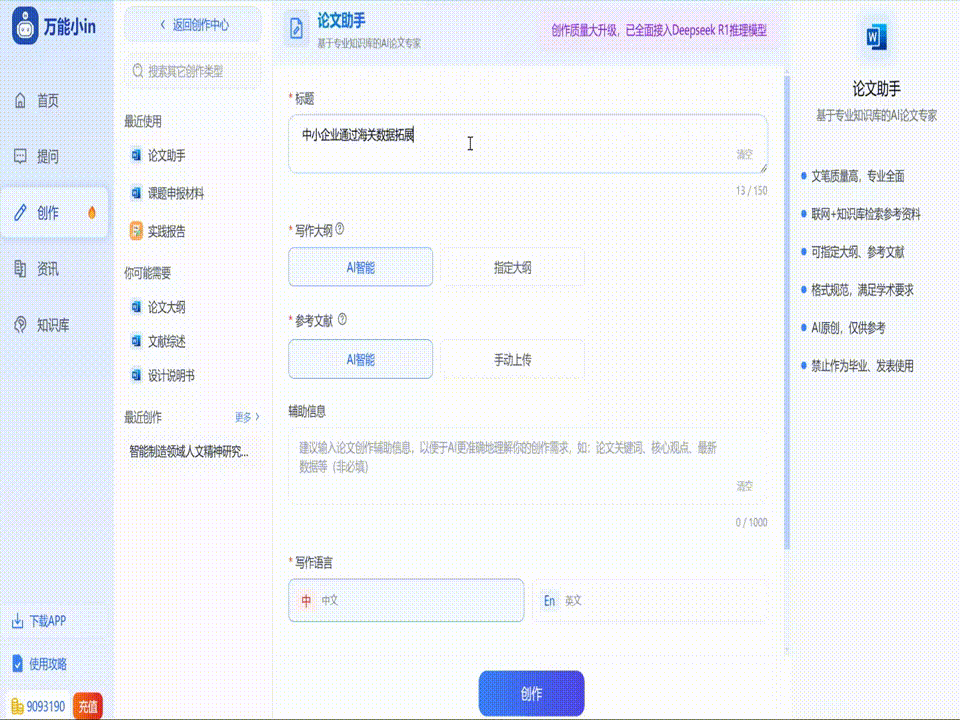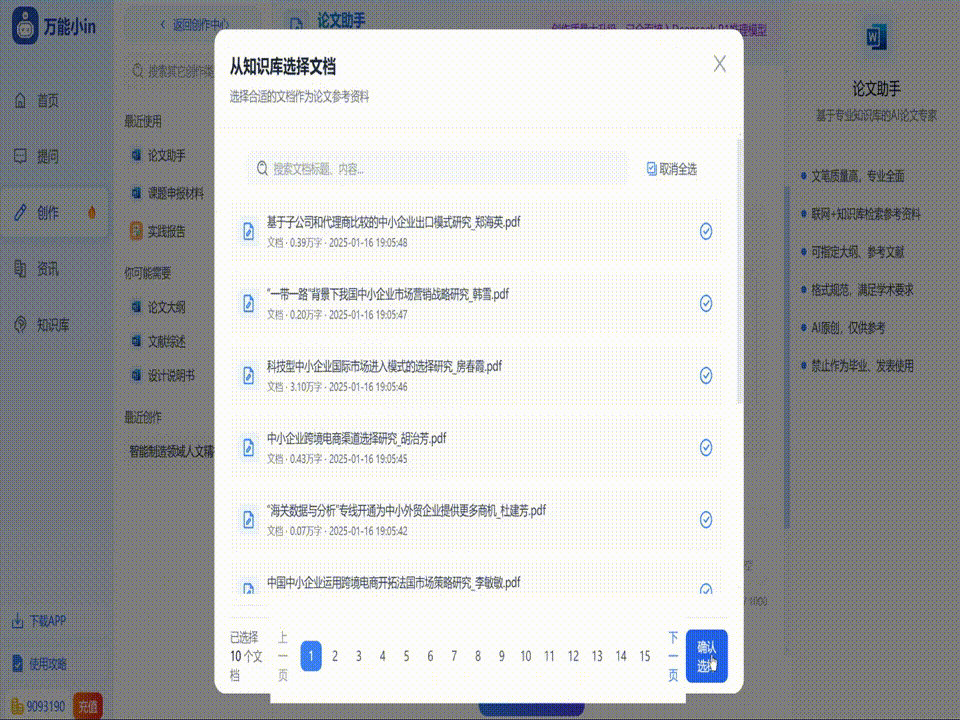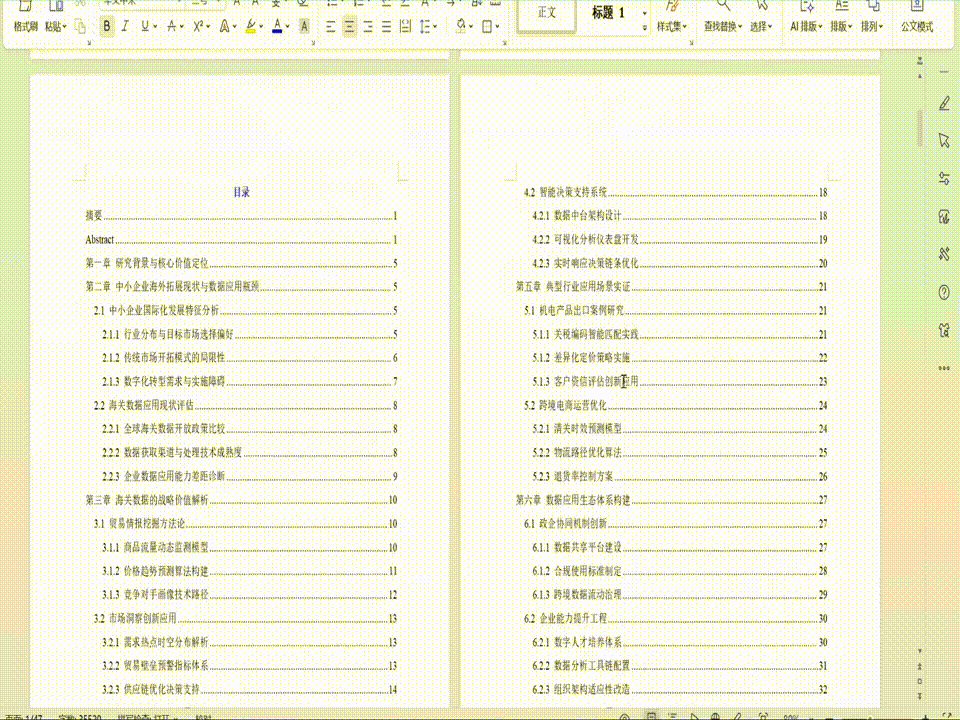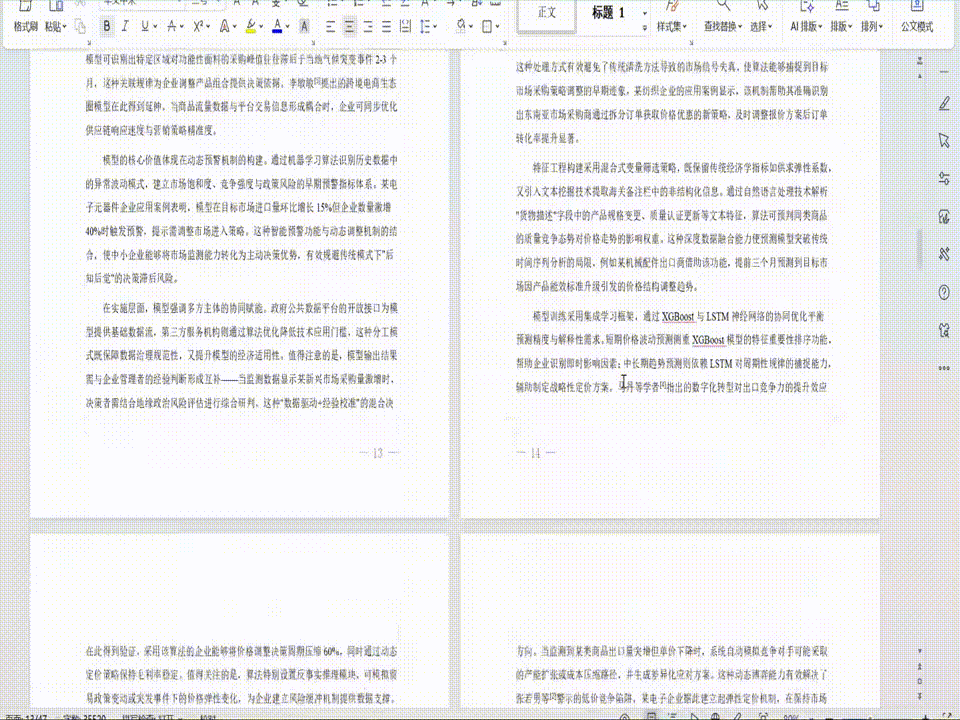
关于基因工程论文的写作指南
写作思路
在撰写基因工程论文时,首先需要清晰地界定研究对象,可以选择一个具体的基因工程技术作为研究重点,如转基因技术、基因编辑(CRISPR/Cas9)等。其次,考虑技术的应用领域,它可以是生物技术、医学、农业等多个方面。分析该技术或具体应用领域的现状、存在的问题及未来的发展趋势,为后续论证、分析提供基础。最后,通过构建论文框架,组织好论点论据,使论文逻辑清晰。
写作技巧
在具体的写作过程中,可以按照以下步骤来组织你的内容:
- 开头:可尝试用引人入胜的例子开篇,或是引用一些权威数据和事实,指出当前所研究的基因工程技术的重要性,然后提出论文的核心主题。
- 组织段落:每个段落应有一个明确的主题句,并围绕此主题进行论述。使用事实、研究数据、引用专业文献等来支持你的中心论点。段落之间的过渡要平滑。
- 结尾:总结研究结果,回顾关键论点,并明晰你对于该技术的看法。可以提出未来研究的方向以增加文章的影响力。
- 修辞手法:利用反问句来挑战读者的既有观念,提出有思考性的问题。同时,运用比喻或类比手法来解释复杂的技术,使之更加通俗易懂。
核心观点或方向
1. 探讨基因工程关键技术的发展历史及其科学价值,以此来确立研究背景,然后向读者论述该技术的重要性。
2. 研究基因工程的伦理及法律问题。基因工程技术虽然带来了大量的潜在机遇,但也伴随着伦理道德和法律上的困惑。通过合理探讨这些问题,引发读者深思。
3. 深入分析特定基因工程产物或技术的实际应用及其对未来社会的影响,例如讲述基因编辑在治疗遗传病中的应用,或者基因工程育种植物对农业带来的影响。
注意事项
撰写基因工程论文时应注意以下几点:
- 确保论文准确无误,在描述基因工程相关的技术细节时,应力求准确,避免夸大其实或误解技术。
- 客观表达。对于基因工程的叙述应保持客观,尤其在讨论伦理与法律问题时,不应偏向于某一立场。同时,应准确引用参考文献来支持你的观点。
- 避免脱离主题。确保讨论始终围绕你的核心研究目标,避免漫无边际的离题讨论。
基因工程论文
摘要
基因工程作为现代生物技术的核心领域,正深刻改变着生命科学的研究范式与应用边界。本研究通过整合技术演进路径与伦理治理框架,系统探讨基因编辑技术在生物医学、农业生产及生态修复等场景中的双重属性。基于CRISPR-Cas9系统的技术突破已实现靶向基因的精准调控,其模块化设计显著提升了遗传物质操作的便捷性,尤其在遗传病治疗领域展现出替代传统疗法的潜力。然而脱靶效应引发的生物安全风险、种系编辑涉及的代际伦理争议,以及基因驱动技术可能造成的生态失衡,构成了技术推广的主要障碍。研究揭示技术创新必须与伦理规范同步发展,建立包含分子层面精准编辑工具开发、细胞层面功能验证体系完善、以及社会层面风险预警机制构建的三维发展路径。展望未来,通过融合合成生物学与人工智能技术,基因工程有望突破现有技术瓶颈,但需在科研共同体、政策制定者与公众之间建立有效的对话机制,以平衡技术革新速度与社会接受度,最终实现基因编辑技术向治疗性、改良性应用的稳健转型。
关键词:基因编辑技术;CRISPR-Cas9系统;伦理争议;生物安全;脱靶效应;未来展望
Abstract
As the core domain of modern biotechnology, genetic engineering is profoundly reshaping the research paradigms and application boundaries of life sciences. This study systematically investigates the dual attributes of gene-editing technologies in biomedical, agricultural, and ecological restoration contexts through the integration of technological evolution pathways and ethical governance frameworks. The breakthrough of CRISPR-Cas9 systems has enabled precise regulation of target genes, with their modular design significantly enhancing the operational efficiency of genetic material manipulation, particularly demonstrating potential to replace traditional therapies in genetic disease treatment. However, three major obstacles hinder technological dissemination: biosafety risks from off-target effects, intergenerational ethical controversies surrounding germline editing, and potential ecological imbalances caused by gene drive technologies. The research reveals that technological innovation must synchronize with ethical norms, advocating a three-dimensional development pathway encompassing molecular-level precision editing tools, cellular-level functional validation systems, and societal-level risk early-warning mechanisms. Looking forward, the integration of synthetic biology and artificial intelligence may help overcome current technical limitations. Nevertheless, establishing effective dialogue mechanisms among scientific communities, policymakers, and the public remains crucial to balance technological advancement with social acceptance, ultimately facilitating the stable transition of gene-editing technologies toward therapeutic and ameliorative applications.
Keyword:Gene Editing Technology;CRISPR-Cas9 System;Ethical Controversies;Biosafety;Off-Target Effects;Future Prospects
目录
第一章 基因工程的发展背景与研究目的
自20世纪70年代DNA双螺旋结构解析以来,分子遗传学的突破性进展催生了基因工程技术。以限制性内切酶的发现为起点,重组DNA技术的建立标志着人类首次实现对遗传物质的定向操作。技术演进初期主要聚焦于基础研究工具开发,包括质粒载体的构建、基因克隆体系的完善,以及原核生物表达系统的建立,这些成果为后续应用研究奠定了技术基础。
随着分子生物学技术的迭代升级,基因工程逐步从实验室研究转向产业化应用。在医疗领域,重组胰岛素与干扰素的成功制备开启了生物制药新纪元;在农业方面,抗虫棉与耐除草剂大豆的培育实现了作物性状的定向改良。特别是人类基因组计划的完成,不仅加速了基因功能解析进程,更推动了基因编辑技术从基因敲除向精准调控的范式转变。技术发展呈现多领域交叉特征,合成生物学与生物信息学的融入使基因操作从单一基因修饰拓展至全基因组层面的系统设计。
当前研究目标聚焦于解决三个维度的核心问题:在技术层面,突破现有基因编辑工具的精准度与效率限制,建立跨物种普适的遗传操作系统;在应用层面,构建覆盖疾病治疗、粮食安全与生态修复的系统解决方案,平衡技术效能与生物安全风险;在伦理层面,探索适应技术发展速度的治理框架,建立包含科研伦理、代际责任与生态平衡的综合评估体系。研究旨在通过技术创新与规范治理的协同发展,推动基因工程从实验性技术向可持续发展模式转型。
第二章 基因编辑技术的核心方法
2.1 CRISPR-Cas9系统的基本原理与优化
CRISPR-Cas9系统的核心机制源于细菌适应性免疫系统的仿生学应用,其通过向导RNA(sgRNA)与Cas9核酸酶形成的核糖核蛋白复合体,实现对特定DNA序列的精准识别与切割。该系统包含两个关键功能结构域:REC叶负责sgRNA与DNA的配对识别,NUC叶则通过HNH和RuvC活性位点执行双链断裂(DSB)。PAM序列(NGG)作为靶点识别的必要条件,既保证了原核免疫系统的自我与非我识别功能,也为真核生物基因编辑提供了特异性保障。
技术优化主要围绕提升编辑精度与效率展开。在sgRNA设计方面,通过热力学稳定性分析优化二级结构,采用截短型sgRNA(tru-gRNA)可显著降低脱靶效应。Cas9蛋白工程化改造则聚焦于:①开发高保真变体如HypaCas9与eSpCas9,通过氨基酸定点突变削弱非特异性结合;②构建切口酶变体(nCas9)与失活型dCas9,分别实现单链切割与基因表达调控功能拓展;③开发xCas9等变体以扩展PAM识别范围至NG、GAA等非经典序列。递送系统的革新同样关键,腺相关病毒(AAV)载体因其低免疫原性成为体内治疗首选,而脂质纳米颗粒(LNP)封装技术则通过优化电荷分布提升了细胞穿透效率。
模块化设计理念推动CRISPR系统向多功能平台演进。通过融合转录激活结构域(如VP64)或表观遗传修饰元件(如DNMT3A),dCas9系统可精准调控基因表达而不引起DNA断裂。光控CRISPR技术将光敏蛋白与Cas9耦合,实现了时空分辨的基因编辑控制。合成生物学策略则通过正交CRISPR系统的构建,使多重基因编辑与逻辑门控操作成为可能。这些技术突破不仅拓展了CRISPR在遗传病治疗中的应用场景,例如通过HDR修复机制校正β-地中海贫血的HBB基因突变,更为复杂性状的多基因协同调控提供了技术基础。
系统优化仍需克服若干技术瓶颈。脱靶效应的分子动力学机制研究揭示,非经典PAM结合与sgRNA部分互补是主要诱因,这促使新型检测技术如GUIDE-seq与CIRCLE-seq的发展。编辑效率的物种依赖性差异则催生了密码子优化策略,通过适配宿主细胞的偏好性密码子提升蛋白表达水平。当前研究正将人工智能算法引入sgRNA设计,利用深度学习模型预测编辑效率与脱靶位点,标志着CRISPR技术进入智能化设计新阶段。
2.2 新型基因编辑工具在医学与农业中的应用
新型基因编辑工具在医学与农业领域的应用已形成差异化技术路径。在生物医学领域,基于CRISPR-Cas9衍生的高精度编辑系统正推动遗传病治疗范式革新。针对单基因隐性遗传病,通过体外造血干细胞编辑联合自体移植,已在β-地中海贫血和镰状细胞贫血治疗中实现功能性治愈。对于显性遗传疾病,单碱基编辑技术可通过C·G至T·A的精准转换,有效纠正亨廷顿舞蹈症相关的HTT基因CAG重复扩增。递送系统的突破使体内编辑成为可能,脂质纳米颗粒封装的mRNA/sgRNA复合体已成功在小鼠模型中修复杜氏肌营养不良症的dystrophin基因突变,其靶向效率较传统腺病毒载体提升显著。
农业生物技术领域,多重基因组编辑系统通过sgRNA阵列设计与Cas9变体优化,实现了作物复杂性状的协同改良。利用胞嘧啶碱基编辑器对水稻OsSPL14基因启动子区进行定向修饰,在不引入外源基因的前提下显著提高分蘖数与产量。新型抗除草剂品种的培育则采用双链断裂依赖的HDR修复机制,在玉米ALS基因中精准引入氨基酸替换突变,使其对新型除草剂的耐受性提升。在抗病虫害方面,通过编辑小麦MLO基因启动子调控区,创制的白粉病抗性品种已进入田间试验阶段,其广谱抗性持续时间较传统转基因品种延长明显。
合成生物学与基因编辑的交叉融合催生了跨物种应用平台。哺乳动物细胞中构建的CRISPR干扰(CRISPRi)系统,通过dCas9-KRAB融合蛋白可逆抑制病毒复制相关基因,为抗病毒药物研发提供新思路。植物合成生物学领域,光诱导型Cas9系统与代谢通路重构技术结合,实现了青蒿素生物合成关键酶基因的时空特异性表达调控,其代谢产物积累量较组成型表达系统提高显著。这些技术突破正在重塑传统育种与药物开发模式,但技术转化仍面临递送效率的物种差异、多基因调控的剂量效应等挑战。
技术应用的风险防控体系同步发展。医学领域建立的双重sgRNA验证机制,通过两个独立sgRNA的协同作用,将编辑特异性提升至临床应用标准。农业生物安全方面,基于分子梳技术的全基因组脱靶检测平台,可系统评估编辑作物中非预期突变的发生频率与遗传稳定性。尽管新型编辑工具大幅降低了脱靶风险,但种系编辑的遗传漂变效应、作物野生近缘种的基因流管控等问题仍需建立更完善的评估模型。
第三章 基因工程的伦理争议与技术挑战
3.1 人类基因改造的伦理边界与社会影响
人类基因编辑技术的突破性进展正在重新定义生命干预的伦理框架。种系编辑引发的代际遗传问题构成了伦理争辩的核心焦点,其不可逆的遗传信息改写可能导致人类基因池的不可控改变,这种跨世代的生物学影响超越了传统医学伦理的评估范畴。2018年贺建奎事件引发的全球学界震动,凸显了种系编辑技术应用在技术成熟度与伦理准备度之间的严重失衡。当前国际共识将可遗传基因编辑严格限定于基础研究,但在治疗性编辑与增强性编辑的边界划定上仍存在重大分歧。
基因增强技术的社会公平性争议日益凸显。理论上可通过基因编辑实现的智力提升、运动能力强化等性状修饰,可能加剧社会资源分配的结构性不平等。这种技术可及性差异不仅存在于国家间的发展鸿沟,更可能在同一社会内部形成基于基因修饰层级的阶层分化。美国国家科学院在《人类基因组编辑》报告中提出的“治疗性应用优先”原则,试图通过技术应用分类来规避增强性编辑的伦理风险,但在实际执行中面临性状连续谱系划分的认知困境。
代际自主权的哲学悖论挑战传统伦理范式。种系编辑干预产生的后代,其基因型选择权被前置于胚胎阶段,这与现代生命伦理学主张的自主原则形成根本冲突。德国伦理委员会提出的“人类尊严不可触碰”原则,强调基因编辑不得改变人类作为道德主体的本质特征,但在实际操作中难以界定何种基因修饰构成本质改变。这种理论困境催生了动态伦理评估体系的构建需求,即建立包含技术风险等级、性状影响范围、社会接受度等多维度的实时评估模型。
社会认知差异对技术治理形成显著制约。不同文化背景对基因编辑的伦理认知呈现显著分化:西方个体主义伦理观强调技术应用的自主选择权,而东方集体主义传统更关注技术对社会整体结构的冲击。这种认知差异在跨国技术监管协调中形成实质性障碍,例如欧盟基于预防原则建立的严格审批制度,与中美等国侧重技术转化的监管框架存在显著冲突。建立全球性伦理治理框架需要突破文化相对主义的局限,在人类共同福祉维度寻求价值共识。
技术风险的社会放大效应加剧公众焦虑。虽然CRISPR-Cas9的脱靶率已通过技术优化显著降低,但媒体传播中的风险放大机制使公众风险感知与技术实际风险间产生严重偏差。这种认知错位不仅影响技术转化进程,更可能引发非理性的技术抵制运动。英国纳菲尔德生物伦理学委员会提出的“社会对话”机制,通过建立科学家、伦理学家与公众的常态化交流平台,有效缓解了干细胞研究初期的社会争议,该模式对基因编辑技术的伦理治理具有重要借鉴价值。
3.2 脱靶效应与生物安全的技术突破路径
脱靶效应作为基因编辑技术临床应用的首要生物安全风险,其分子机制研究已揭示sgRNA非特异性配对与Cas9蛋白结构动态性的内在关联。sgRNA与基因组DNA的错配容忍度受自由能变化调控,当互补区5’端出现非经典碱基配对时,Cas9的REC叶构象改变会触发异常切割活性。HNH与RuvC结构域的变构效应进一步扩大了脱靶窗口,特别是在染色质开放区域更易产生非预期编辑事件。这种技术局限性在体内编辑中尤为显著,因为细胞周期状态与DNA修复通路异质性会加剧脱靶突变的累积。
针对脱靶效应的技术突破路径呈现多维度创新态势。在sgRNA设计层面,基于热力学稳定性预测的算法优化显著提升了靶向特异性,截短型sgRNA(tru-gRNA)通过缩短互补区长度降低错配容忍度。Cas9蛋白工程改造聚焦于关键结构域的重构:高保真变体如HypaCas9通过FokI二聚体界面的氨基酸突变限制非特异性切割;eSpCas9则通过负电荷引入削弱核酸酶与DNA骨架的非特异性相互作用。双sgRNA验证系统的建立将脱靶率降至检测阈值以下,其通过两个独立sgRNA的协同作用确保仅目标位点被双重识别后激活切割功能。
新型检测技术的开发为生物安全评估提供了精准工具。GUIDE-seq通过捕获基因组中Cas9结合位点实现全基因组脱靶位点检测,其灵敏度较传统全基因组测序提升显著。CIRCLE-seq利用体外环化基因组DNA进行高通量测序,可系统识别潜在脱靶位点的序列特征。单细胞测序技术的整合应用,使得在复杂组织环境中追踪低频脱靶事件成为可能,这对评估体内编辑的生物安全性具有关键意义。
递送系统的优化在提升编辑特异性方面发挥重要作用。脂质纳米颗粒(LNP)的电荷分布调控可增强细胞膜穿透效率,其瞬时表达特性避免了病毒载体可能导致的持续Cas9活性。自灭活型CRISPR系统的设计通过引入降解标签实现核酸酶活性的精准时空调控,将非预期编辑时间窗缩短。基于RNA病毒的瞬时递送体系则通过限制Cas9蛋白表达周期,在完成靶向编辑后快速清除编辑元件。
合成生物学策略为脱靶效应控制提供了新思路。正交CRISPR系统的构建通过设计物种特异性Cas9变体,在人类细胞中实现完全正交的基因编辑操作,有效规避内源序列干扰。光控CRISPR技术将光敏蛋白与Cas9耦合,通过光照强度与波长精确调控编辑活性时空分布,在保证靶向效率的同时将脱靶事件限制在可控范围。这些技术突破与人工智能预测模型的结合,正在推动基因编辑从经验优化向理性设计转变。
第四章 基因工程的未来展望与结论
基因工程的技术演进正朝着精准化与智能化方向加速发展。下一代编辑工具的开发将突破现有CRISPR系统的物理限制,基于蛋白质工程与深度学习算法的新型编辑器,可实现单碱基分辨率下的全基因组覆盖编辑。合成生物学与基因电路的整合应用,使得多基因协同调控网络的设计成为可能,这将推动定制化细胞治疗与人工合成生命系统的构建。在农业领域,模块化编辑平台与表观遗传调控技术的结合,有望实现作物复杂性状的定向进化,同时规避传统转基因技术的外源基因整合风险。
技术创新的伦理框架构建需要形成动态平衡机制。通过建立全球协同的治理网络,将技术风险评估从实验室阶段延伸至生态系统层面,特别是对基因驱动技术的生态影响进行跨代际追踪。代际伦理争议的解决路径在于完善种系编辑的决策参与机制,开发可逆性基因修饰技术与跨世代监测模型。公众认知的科学化转型亟需建立可视化风险沟通平台,利用虚拟现实技术模拟基因编辑的生物学效应,提升社会对技术本质的理解深度。
跨学科融合正在重塑基因工程的发展范式。人工智能技术的深度介入不仅优化了sgRNA设计与脱靶预测,更通过多组学数据整合推动了全基因组功能解析。纳米材料与合成生物学的交叉创新,开发出具有环境响应特性的智能递送系统,可实现组织特异性的时空可控编辑。在生态修复领域,合成微生物群落的定向改造技术,为重金属污染治理与碳汇提升提供了全新解决方案,但其生态位替代风险需要建立基于系统生物学的预警模型。
基因工程的可持续发展必须建立在技术创新与社会价值的协同进化之上。当前研究证实,通过分子层面的精准编辑工具开发、细胞层面的功能验证体系完善、以及社会层面的风险预警机制构建,可形成三维协同发展路径。未来技术突破将依赖于科研共同体、政策制定者与公众之间的有效对话机制,特别是在增强性编辑的边界界定与全球技术标准统一方面需要达成跨文化共识。唯有在生物安全与伦理规范的双重约束下推进技术革新,才能使基因工程真正实现从基础研究向普惠性应用的稳健转型。
参考文献
[1] 殷亚妮.例谈用科技论文命制“基因工程”原创试题[J].《中学生物学》,2022年第2期59-61,共3页
[2] 王家骥.谨防生物技术被滥用于发展危害人类的基因武器——斯德哥尔摩国际和平研究所1999年《世界军备和裁军年鉴》所载《生物技术和遗传工程发展的利弊》论文简介[J].《国际问题研究》,2000年第2期56-58,共3页
[3] 叶卫杰.以学术论文为情境的基因工程相关试题命制[J].《生物学教学》,2023年第7期61-63,共3页
[4] 阿斯古丽·伊斯马伊力.基于科研能力培养的基因工程实验教学改革探索[J].《中文科技期刊数据库(全文版)教育科学》,2024年第3期0148-0151,共4页
[5] 智海东.我国兽用基因工程疫苗研发现状与策略[J].《动物医学进展》,2011年第6期174-178,共5页
撰写基因工程论文是一项复杂而细致的工作,涉及到前沿科技的理解与应用。希望本文提供的背景知识、研究方法和案例分析能够帮助读者更好地把握基因工程技术的核心要点,提升论文写作的质量与深度。当然,借助小in这样的写作工具,可以更高效地开展研究,构思并完成高质量的学术论文。
 下载此文档
下载此文档 更多推荐
更多推荐
